Isotop: Im Atomgewicht aufgrund unterschiedlicher Neutronenzahl abweichende Variante eines  Elements. – Da die chemischen Eigenschaften eines Elements (Farbe, Bindungsfähigkeit usw.) ausschließlich durch seine Elektronenhülle bestimmt werden (die Neutronenzahl des Kerns also keine Rolle dabei spielen kann), haben die ~e somit die gleiche Ordnungszahl im Mendelejew'schen Periodensystem, befinden sich dort also am gleichen Platz (gr.
Elements. – Da die chemischen Eigenschaften eines Elements (Farbe, Bindungsfähigkeit usw.) ausschließlich durch seine Elektronenhülle bestimmt werden (die Neutronenzahl des Kerns also keine Rolle dabei spielen kann), haben die ~e somit die gleiche Ordnungszahl im Mendelejew'schen Periodensystem, befinden sich dort also am gleichen Platz (gr. 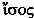 »gleich«,
»gleich«, 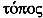 »Platz«). Da eine höhere Neutronenzahl die Stapelung der Bestandteile des Kerns (Protonen und Neutronen) erschwert, sind schwere ~e häufig weniger stabil als leichtere, zerfallen also leichter, sind somit eher radioaktiv oder stärker radioaktiv als die leichteren. Man unterscheidet die verschiedenen ~e eines Elements durch das als Indexziffer vor oder (weniger gut) hinter das chemische Symbol gesetzte Atomgewicht: 14C oder C14 ist somit Schwerer Kohlenstoff (im Gegensatz zum stabileren und häufigeren 12C), 2H ist Schwerer Wasserstoff usw. –
»Platz«). Da eine höhere Neutronenzahl die Stapelung der Bestandteile des Kerns (Protonen und Neutronen) erschwert, sind schwere ~e häufig weniger stabil als leichtere, zerfallen also leichter, sind somit eher radioaktiv oder stärker radioaktiv als die leichteren. Man unterscheidet die verschiedenen ~e eines Elements durch das als Indexziffer vor oder (weniger gut) hinter das chemische Symbol gesetzte Atomgewicht: 14C oder C14 ist somit Schwerer Kohlenstoff (im Gegensatz zum stabileren und häufigeren 12C), 2H ist Schwerer Wasserstoff usw. –
Radioaktive ~e vieler Stoffe spielen als Abfallprodukte von Kernspaltungsprozessen (Atombombenversuche, Reaktorunfälle u.ä.) oft eine verhängnisvolle Rolle als Krankheitsverursacher (da die Organismen evolutiv auf deren unerwartbare Menge nicht eingestellt sein können), sind andererseits aber oft sehr nützlich als medizinische Diagnosehilfsmittel.



